NHK スペシャル「人体」シリーズ第 2 集「驚きのパワー!“脂肪と筋肉”が命を守る」で紹介されていた論文である.筋肉もまた様々なメッセージ物質を出して体内の臓器と対話している分泌臓器である,という視座を提供した点でこの論文の功績は大きい.2018 年 7 月時点での被引用回数は 1000 を超える.
筋トレはもはやボディビルダーやトレーニーの専売特許ではない.単に肉体を改造するだけでなく,代謝疾患や癌など人間を苦しめる病気を予防する優れた手段であることが,最新の科学研究によって分かってきた.運動が人の生命予後を改善することは疫学的には分かっていたのだが,その分子生物学的な機序がようやく明らかになってきた.今回はこの論文の全訳を紹介する.
この論文の著者はコペンハーゲン大学の Bente Klarlund Pedersen 博士だが,論文引用の順番がきちんと文章通りになっていて非常に読みやすい.普通の論文だと引用の順番がぐちゃぐちゃで大変読みにくいのだが,きちんとした人なんだろうなと思わされる.いや,どうでもいいんだけどね.

Muscles, exercise and obesity: skeletal muscle as a secretory organ Nature Reviews Endocrinology volume 8, pages 457–465 (2012)
Abstract
During the past decade, skeletal muscle has been identified as a secretory organ. Accordingly, we have suggested that cytokines and other peptides that are produced, expressed and released by muscle fibres and exert either autocrine, paracrine or endocrine effects should be classified as myokines. The finding that the muscle secretome consists of several hundred secreted peptides provides a conceptual basis and a whole new paradigm for understanding how muscles communicate with other organs, such as adipose tissue, liver, pancreas, bones and brain. However, some myokines exert their effects within the muscle itself. Thus, myostatin, LIF, IL-6 and IL-7 are involved in muscle hypertrophy and myogenesis, whereas BDNF and IL-6 are involved in AMPK-mediated fat oxidation. IL-6 also appears to have systemic effects on the liver, adipose tissue and the immune system, and mediates crosstalk between intestinal L cells and pancreatic islets. Other myokines include the osteogenic factors IGF-1 and FGF-2; FSTL-1, which improves the endothelial function of the vascular system; and the PGC-1α-dependent myokine irisin, which drives brown-fat-like development. Studies in the past few years suggest the existence of yet unidentified factors, secreted from muscle cells, which may influence cancer cell growth and pancreas function. Many proteins produced by skeletal muscle are dependent upon contraction; therefore, physical inactivity probably leads to an altered myokine response, which could provide a potential mechanism for the association between sedentary behaviour and many chronic diseases.
過去 10 年間で,骨格筋は分泌臓器であると同定された.ゆえに我々は提案してきた.つまり,筋線維によって産生され,発現され,放出され,自己分泌,傍分泌または内分泌のいずれかの作用を発揮するサイトカインおよび他のペプチドは,マイオカインとして分類されるべきであると.筋分泌細胞が数百個の分泌ペプチドからなるという知見は,脂肪組織,肝臓,膵臓,骨および脳のような他の臓器と筋肉がどのように会話するかを理解するための概念的根拠および全く新しいパラダイムを提供する.しかし,一部のマイオカインは筋肉自体に対してその効果を発揮する.したがって,ミオスタチン,LIF, IL-6 および IL-7 は,筋肥大および筋形成に関与するが,BDNF および IL-6 は,AMPK を介する脂質酸化に関与する.IL-6 はまた,肝臓,脂肪組織および免疫系に全身作用を及ぼし,腸管 L 細胞と膵島との間のクロストークを媒介する.他のマイオカインには,骨形成因子 IGF-1 および FGF-2 が含まれる.FSTL-1 は血管系の内皮機能を改善する.PGC-1α 依存性マイオカインであるアイリシンは褐色脂肪様の分化をもたらす.過去数年間の研究は,筋細胞から分泌されるまだ同定されていない因子の存在を示唆しており,癌細胞増殖および膵臓機能に影響を及ぼす可能性がある.骨格筋によって産生される多くの蛋白質は収縮に依存する.したがって,運動不足はおそらくマイオカイン応答を変化させ,これは座位行動と多くの慢性疾患との間の関連の潜在的機序を提供する可能性がある.
Introduction
健常人と患者における代謝のホルモン調節の観点は過去 20 年間で大きく変化した.それは主に脂肪組織への多大な研究に負うところが大きい.当初は中性脂肪の不活性な貯蔵庫だと考えられていたが,1980 年代半ばからの先進的な研究が,脂肪細胞は特異的な分泌蛋白で補体因子 D またはアディシンと呼ばれるものを豊富に含むことが証明された (1). 10 年以上前,画期的な発見で,Zhang らはレプチンを同定した (2). これは脂肪細胞に特異的な因子で肥満 ob/ob マウスで欠損しているものであり,脂肪組織と脳の間で標準的なホルモンのシグナル伝達を仲介する.ゆえに,アディポネクチン,レジスチン,ニコチンアミドホスホリボシルトランスフェラーゼ(ヴィスファチンとして知られる)およびレチノール結合タンパク 4 が,アディポカインの成長するリストに追加された (3). アディポカインは代謝的に活性な組織に影響を及ぼす循環因子としての役割に関して多くの研究に焦点を当ててきた.しかし,収縮において,筋細胞は生理学的および病態生理学的に細胞静止に対する最も著明な変化の一つを受けることは強調しておく必要がある.さらに,運動は代謝と他の諸臓器に影響を及ぼす.筋肉は,それゆえに,局所的にも内分泌効果においても,分泌分子の重要な根源の代表となる可能性があった.
アディポネクチン以外は (4), 脂肪細胞により産生される因子の大部分は炎症誘発性である.例えば,TNF, CCL2, PAI-1 など,肥満誘発性の代謝性疾患および心血管疾患の進展に関して潜在的に有害である.この理解は重要な疑問を提起している.つまり,どの組織が防御的で,脂肪細胞により産生される炎症誘発因子に対するバランスを取る可能性があるのか?
短期間の運動不足でさえ代謝性変化に関連しており,インスリン感受性を低下させ,食後の脂質代謝を減弱させ,筋肉量を減少させ,血管への脂質沈着を促進する (5,6). このような異常はおそらく運動の減少が慢性疾患の進行と早期死亡率とのリスクを上昇させる関連性を代表している (7). 運動不足は 2 型糖尿病 (T2DM) のリスクを増加させ (8), 心血管疾患 (9), 大腸癌 (10), 閉経後の乳癌 (11) および骨粗鬆症 (12) のリスクを増加させる.合理的な提案はこうである.つまり,骨格筋が,炎症誘発性アディポカインの有害な効果に対抗する何らかの蛋白質を分泌することで,運動による何らかの確立された防御効果を仲介している可能性があるというものである (Figure 1).
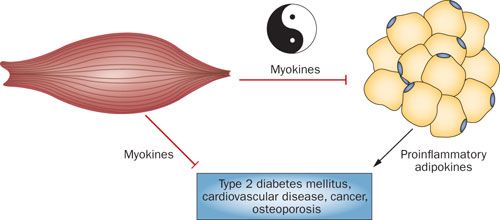
balance. Especially under conditions of obesity, adipose tissue secretes
adipokines, which contribute to establish a chronic inflammatory environment that promotes pathological processes such as atherosclerosis and insulin resistance. Skeletal muscles are capable of producing myokines that confer some of the health benefits of exercise. Such myokines might counteract the harmful effects of proinflammatory adipokines.
筋細胞がある液性因子を産生し放出するというアイデアは,脂肪組織が分泌臓器として同定されたよりも数年前に遡る.過去半世紀近くにわたり,研究者たちはこのように仮定してきた.つまり,骨格筋が「液性」因子を処理するのは,収縮の間だけグルコース需要が亢進する反応において放出されるものであると (13). 現在まで,より正確な知見がないことから,まだ同定されていない収縮誘発性因子は ‘the work stimulus’ や ‘the work factor’ または ‘the exercise factor’ と名付けられた (14).
我々の見解では,複数形の ‘exercise factors’ は,複数の代謝的・生理学的変化が運動により誘発されるという事実から,もっと適用可能だろうと思われる.’Exercise factor’ の概念の初期の見解は次の事実に基づいて述べられていた.つまり,収縮中の骨格筋は他の臓器での代謝的・生理学的反応を仲介するが,それは神経系を経由したものではないということである.すなわち,脊髄損傷のために求心性インパルスも遠心性インパルスもない麻痺した筋肉を電気刺激することで,損傷のない個体と同等の多くの生理学的変化を誘発することができたのである (15,16). 骨格筋の収縮は,それゆえに,他の臓器と体液性因子を介して会話することができるに違いなく,それは運動中に循環器系に放出されるものであろう.そのような因子は直接または間接的に他の臓器,たとえば脂肪組織や肝臓,心血管系や脳などの機能に影響を与える可能性があった.
骨格筋は痩せた男女の体重の約 40 % を構成し,ゆえに,肥満でないヒトにおいて最大の臓器を構成している.過去 10 年間において,筋細胞は高い分泌能を有する細胞であると同定され,脂肪細胞が主要な内分泌細胞であるとの概念を支持している.筋細胞は数百種もの分泌因子を産生する能力があると考えられている (17,18,19). 2003 年,Pedersen らは,筋線維により産生され,発現され,放出され,また内分泌効果を発揮するサイトカインや他のペプチドを,マイオカインとして分類すべきであると提唱した (14).
骨格筋を分泌臓器として定義することは新しいパラダイムを創造した.筋肉はマイオカインを産生し,放出する.それはホルモン用の様式で作用し,遠隔臓器に対して特異的な内分泌効果を発揮する.骨格筋で産生されるが循環器系に乗らない他の蛋白質はオートクリンやパラクリンの機序を経由して作用する可能性があり,筋肉自身のシグナル経路を介して効果を発揮する (20,21,22,23,24,25). ゆえに,マイオカインは運動による複数の健康上の利益を仲介している可能性がある.本レビューは現在までに同定された筋由来サイトカインの最新版を提供するものである (Figure 2). さらに,骨格筋を内分泌臓器として定義することには臨床的意義がある.それは本レビューでハイライトするが,骨格筋が演ずる臓器同士の対話の中核であり,筋肉と肝臓および筋肉と脂肪組織の対話を含むものである.
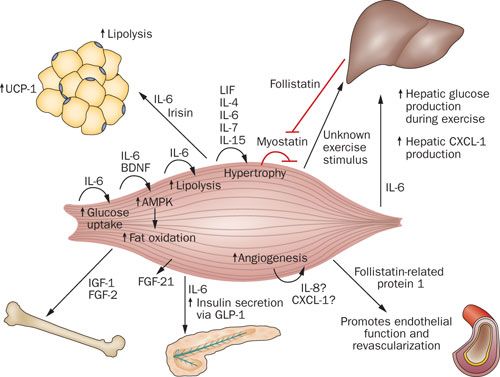
Myostatin
ミオスタチン(成長/分化因子 8 としても知られる)は,マイオカインの定義を満たした最初の筋肉分泌因子である.この蛋白質は循環器系に分泌される.ミオスタチンは高度に保存された TGF-β スーパーファミリーの一員であり,ミオスタチン遺伝子の不活性化(ノックアウト)はマウス (26), ウシおよびヒト (27) において著明な筋肥大をもたらす.骨格筋の成長におけるミオスタチンの制御の役割に加えて,このマイオカインはまた代謝の恒常性および脂肪組織の機能と量を修飾する調整にも関連している (28,29,30,31). マウスでのミオスタチン欠損は付随的に骨格筋肥大をもたらし,全身脂肪組織の減少をもたらす (32,33).
ヒトおよびげっ歯類において,好気性および筋力トレーニングはミオスタチン発現を減少させる一方で,ミオスタチンの不活性化は代謝的に持久性運動の有益な効果を増強するように見える (34). 肥満がミオスタチン発現の増加と関連しているとのエビデンスがいくつか証明されている.筋肉と循環系内ミオスタチン蛋白量が肥満個体では増加しており,さらに,筋管からのミオスタチン分泌は筋生検標本から単離された筋芽細胞に由来しており,痩せた女性よりも肥満女性において増加している (35).
フォリスタチンは TGF-β スーパーファミリーの他の一員であるが,骨格筋における制御の枠割に関する自然発生するミオスタチン阻害因子である.血清フォリスタチン濃度は急速な自転車運動後に健常個体で上昇し,ピーク濃度は 7 倍に達する.しかし,運動肢ではフォリスタチン放出は認められず,収縮中の骨格筋がフォリスタチン源ではないことが示唆されていた.マウスに水泳運動をさせた際,フォリスタチン mRNA および蛋白発現の著明な増加が血清および肝臓で認められた.フォリスタチンの全身での濃度増加は,主に筋肉でのミオスタチン発現の運動関連制御に寄与している可能性がある.フォリスタチンはおそらくマイオカインとしてではなくむしろヘパトカインとして分類されるべきだろうが,これらのデータは運動中および運動後の筋肉-肝臓間の対話の可能性を示唆している (36).
IL‑6
サイトカイン IL-6 は筋収縮に反応して血液中に分泌されるマイオカインとして最初に発見された (23). このサイトカインは偶然マイオカインとして発見されたもので,運動時間および運動に参加する筋肉量に比例して濃度が指数関数的に上昇する.ゆえに,血清 IL-6 濃度は運動に反応して 100 倍にも上昇するが,それほど劇的でない増加ならもっと頻繁にある (37). IL-6 はヒトの筋芽細胞 (38,39), ヒト培養筋芽細胞 (40), 成長しているネズミの筋線維および筋幹細胞(サテライト細胞)で発現している (41). 加えて,IL-6 は健常個体および 2 型糖尿病患者由来の一次培養ヒト筋肉細胞から放出されている (42,43).
興味深いことに,運動中の循環器系における IL-6 濃度上昇はいかなる筋損傷の徴候も伴っていない (37). 今世紀初頭に至るまでは一般に次のように考えられていた.つまり,運動中の IL-6 濃度上昇は免疫反応の結果であり,作動筋の局所的な損傷によるものであり (44), マクロファージがこの増加の原因であると (45). しかし,単球での IL-6 mRNA 濃度は運動の結果上昇していなかった (46). この知見は蛋白質濃度とも一致していた (47,48). こんにち,筋細胞は運動中の IL-6 産生の主要源として知られている (49). 肝臓で IL-6 を除去することは次の機序を構成している.つまり,循環器系内の IL-6 濃度の慢性的な上昇による代謝的な負の効果が制限されるのである.
いくつかのエビデンスが,IL-6 は運動中の筋細胞による産生されるという概念を支持している.細胞核での IL-6 転写率および IL-6 mRNA 濃度は運動開始から 30 分以内に急速かつ著明に増加する (50,51). それの示唆するところは,収縮に関連するある因子が筋細胞核での IL-6 転写の調節に関わっているということである.さらなるエビデンスは,筋線維自身が IL-6 mRNA の源そのものであり,in situ ハイブリダイゼーションおよび免疫組織化学染色手法で生検標本から得られた解析により,その蛋白質が得られたことである (52). 微量透析研究の示唆するところは,収縮中の骨格筋内の IL-6 濃度は循環器系で見出されるそれの 5 倍から 100 倍にまで達することと,運動中および運動後に間質および筋線維内に IL-6 が蓄積するという概念を支持するものである (53). 動静脈および運動中の下肢を横切る血流の IL-6 濃度を同時に計測することで,膨大な量の IL-6 が運動中の筋肉から循環血中に放出されていることが証明された (54).
ヒトの骨格筋は以下の点でユニークである.つまり TNF 非依存様式で厳密に収縮中に IL-6 を産生できる (40). この知見の示唆するところは,筋由来 IL-6 は炎症よりむしろ代謝における役割を有していることである.この仮定を支持するように,筋肉内グリコーゲン濃度が低い時には,筋肉内の IL-6 mRNA 発現 (55) と IL-6 蛋白放出 (56) の両者は著明に強化される.これは IL-6 がエネルギーセンサーとして働いていることを示唆している (57,58,59,60). この考えはおびただしい研究によって支持されており,運動中のグルコース摂取が運動誘発性血清 IL-6 増加を減衰させること,収縮中のヒト骨格筋からの IL-6 放出を阻害することが証明されている (23,61).
骨格筋は規則的な運動に反応して蛋白質の種類と量を変更する能力のある組織である.骨格筋における運動誘発性適応は,運動前の骨格筋含有グリコーゲンを増加させ, β 酸化に関連する重要な酵素を活性化させ,脂肪組織を活性化してエピネフリンによる脂肪分解を増加させ,さらに筋肉内の中性脂肪の酸化を亢進する.結果として,トレーニングされた骨格筋は脂肪を基質として利用可能となり,運動中の基質として血清および筋肉内のグルコースに依存しなくなる (23,62). いくつかの疫学研究が報告したところによると,規則的な運動と安静時の血清 IL-6 との間には負の相関がみられ,運動が活発になるほど IL-6 濃度は低くなった (37). 対照的に IL-6 濃度の高い状態は運動不足およびメタボリック症候群と相関していた.さらに,血清 IL-6 および筋由来 IL-6 mRNA 濃度の運動誘発性増加は,持久性トレーニングで減少する (63).
興味深いことに,安静時血清 IL-6 濃度は持久性トレーニングでダウンレギュレートされるにもかかわらず,安静時の筋肉の IL-6Rα 発現はアップレギュレートされる.持久性トレーニングへの反応として,筋肉における基底 IL-6Rα mRNA 濃度は増加して 100% にまで至る (55). ゆえに,筋力トレーニングでは,IL-6 ダウンレギュレーションは一部 IL-6Rα 発現増加により相殺され,IL-6 感受性が亢進することになる.我々の仮定では,筋肉を使用せずにいると IL-6 抵抗性および循環血中 IL-6 濃度が上昇し,それと並行してインスリン抵抗性が増加して高インスリン血症となり,レプチン抵抗性が増加して慢性的に循環血中のレプチン濃度が上昇することになる.
ラットの筋細胞に in vitro で IL-6 を急速に作用させると,基底状態のグルコース取り込みおよびグルコース輸送体の GLUT4 の膜輸送が亢進した (64). さらに IL-6 は in vitro での筋細胞でのインスリン刺激によるグルコース取り込みを亢進させた.この知見は臨床との関連性を示しており,遺伝子組換えヒト IL-6 製剤を高インスリン血症の健常個体に注射すると,グルコースクランプ装置では全身のインスリン感受性を亢進させた.IL-6 での処置により,内因性グルコース産生の総量を抑制することなくグルコース注入量を増加させたのである (64). In vitro では IL-6 のグルコース取り込みにおける効果は AMPK 活性化を介して発現していたが,dominant-negative AMPK を発現する遺伝子組み換えアデノウイルスを感染させた筋細胞での結果は廃止された (64).
いくつかの試験では IL-6 はまた,筋細胞内 (64,65,66) および全身 (67) の脂肪酸の酸化を AMPK を介して亢進する (64,68) ようである.IL-6 は IL-6Rβ を経由して急速にシグナル伝達し(これは糖蛋白 130 [gp130] としても知られている),多くのレプチン様の作用を発現する.例としては AMPK 活性化 (69,70,71), インスリンシグナル伝達 (72) などである.興味深いことに, IL-6 ノックアウトマウスは遅発性の肥満と耐糖能異常を発症するのだが (73), そのことは IL-6 が代謝において有益な効果を発揮するという概念を支持するものである.
重要なこととして,IL-6 は基本的な生物学的活性を有するマイオカインであり,運動中の肝臓でのグルコース産生に寄与している (74). 筋肉の作用する間にグルコースが産生され除去される堅固な制御の機序は不明である.まだ発見されていない,内因性グルコース産生における収縮誘発性増加に影響する ‘work factor’ の存在が示唆されている.遺伝子組み換えヒト IL-6 製剤を安静状態のヒト個体に急速静注して生理学的濃度に達しても,全身でのグルコース処理,グルコース取り込みおよび内因性グルコース産生には影響がなかった (66,75,76). 対照的に,IL-6 は内因性グルコース産生の収縮関連増加に寄与している.遺伝子組み換えヒト IL-6 製剤を低強度で運動中の健康なボランティアに投与したところ,目的は高強度での運動中に観測される循環血中の IL-6 濃度を模倣することなのだが,グルコース出力は高強度での運動中と同等に高かった.この研究は筋肉と肝臓の直接のクロストークを証明したものである.IL-6 はヒトにおける内因性グルコース産生の役割を有することが証明された.しかし,その肝臓での作用は,まだ同定されていない筋収縮誘発性因子に依存している (74).
遺伝子組み換えヒト IL-6 製剤の健康個体への投与は脂肪分解の増加を引き起こしたが,高中性脂肪血症やカテコラミン,グルカゴン,インスリンの変化および他の副作用は見られなかった (66,67,76). 細胞培養実験を含めたこれらの知見からは,IL-6 が脂肪分解と脂肪酸酸化の両者に直接効果を有しており,IL-6 の同定は脂肪分解因子であることを示している (66). 健康な人に IL-6 を投与して生理的濃度に達すると,主に骨格筋での脂肪分解が刺激されるが,脂肪組織は影響を受けない (77).
IL-6 はおそらく運動における何らかの抗炎症作用および免疫調整効果を介している (78,79). IL-6 はヒト培養単球においてリポ多糖誘発性 TNF 産生を阻害し (80), 抗 IL-6 抗体を投与したマウスや IL-6 ノックアウトマウスでは TNF 濃度が著明に上昇するが (81), それは循環血中 IL-6 が TNF 濃度の制御に関与していることを示唆している.加えて,健康な個体では遺伝子組み換えヒト IL-6 製剤投与も運動もエンドトキシン誘発性の循環血中 TNF 濃度の上昇を阻害する (82). IL-6 の抗炎症効果はまた IL-6 が古典的な抗炎症サイトカインである IL-1ra および IL-10 の産生を刺激することにより証明された (83).
IL‑7
Haugen らは IL-7 をマイオカインとして同定した (42). IL-7 は T 細胞と B 細胞の分化の際に要求されるサイトカインであるが,一方で,非免疫細胞における IL-7 の可能性のある生物学的機能は探索されてこなかった.IL-7 mRNA および蛋白質は主にヒト培養筋管の条件つき培地および筋管から検出された.培地中の IL-7 の量はインキュベーション時間と共に増加した (42). ヒト筋芽細胞を分化の際に遺伝子組み換え IL-7 と共にインキュベーションすると,最終筋形成マーカーであるミオシン重鎖 2 および myogenin の mRNA 濃度の減少を誘導した.この知見は IL-7 がサテライト細胞に作用する可能性があることを示唆している.サテライト細胞とは成熟筋細胞で見つかった小さな単核の前駆細胞のことである.Haugen らはまた,筋力トレーニングを経験した男性被検者の安静時の外側広筋および僧帽筋からの生検標本において筋肉での IL-7 mRNA 発現が数倍に増加していることを証明した (42).
IL‑8 and CXCL‑1
IL-8 はケモカインの巨大なファミリーに属する.このマイオカインは主にマクロファージと血管内皮細胞で産生され,白血球遊走の強力な活性を発揮し,さらに,血管新生因子でもある.ネズミのケモカインである CXC ligand 1 (CXCL-1) はヒト CXCL-1 と最も高い配列相同性を有しており,しかししばしばヒト IL-8 との機能的相同性について言及される (84). CXCL-1 および IL-8 は好中球遊走活性を有している.さらに,それらは血管新生の過程にも関連している (85). IL-8 の血管新生を誘発する能力は炎症を誘発する能力とは異なる (86). IL-8 は CXC ケモカイン受容体である CXCR-1 および CXCR-2 に結合する (87). CXCR-2 はヒト毛細血管内皮細胞で発現しており,IL-8 誘導性血管新生に対応する受容体である (88).
CXC ケモカインの異なる受容体産生は IL-6 により誘導される (89). ネズミ CXCL-1 の調節における運動と IL-6 の役割が,それゆえ,研究されてきた (90). 1 回の運動後,CXCL-1 mRNA 濃度が血清,筋肉および肝臓で増加した.肝臓での CXCL-1 mRNA の運動誘発性の発現の調節は, IL-6 ノックアウトマウスでは完全に鈍かった.IL-6 が過剰発現したネズミの筋肉では血清 CXCL-1 および肝臓での CXCL-1 mRNA 発現が著明に増加していた.これらのデータは運動中の堅牢な筋肉-肝臓間のクロストークを証明するものであり,運動誘発性の IL-6 産生は肝臓での CXCL-1 産生を刺激するものである.その研究では肝臓での CXCL-1 発現が筋肉と比較してはるかに高かった.しかし,筋肉の IL-8 mRNA 濃度は運動により増加し (91), IL-8 はヒト一次培養筋管により放出される (42). 肝由来および筋細胞由来の IL-8 の生物学的役割は分かっていない.
LIF
LIF は 1988 年に腹水腫瘍細胞から分泌される蛋白質として同定された (92). このマイオカインは IL-6 サイトカインスーパーファミリーに属し,ニューロポイエチンという名の蛋白質 (gp130) と構造的にも機能的にも類似している (93). LIF には多様な生物学的機能があり,血小板形成の刺激,造血細胞の増殖,骨形成,神経の生存および形成,そして肝細胞による急性期産生である (94). さらに,LIF はサテライト細胞増殖を誘導し,それは筋肥大と筋再生に必須の役割と考えられている (95).
LIF mRNA 発現は筋力トレーニングの間にヒト骨格筋で誘導され,LIF 蛋白質はヒト培養筋管を電気刺激しても分泌される (96). さらに,シグナル分子 PI3K および mTor による化学的阻害および低分子干渉 RNA (siRNA) での Akt1 をノックダウン (silencing) は独立して十分に LIF をダウンレギュレートした.さらに,LIF はヒト筋芽細胞増殖を刺激し,ヒト筋管細胞での jun-B および C-Mic 発現を誘導した.対照的に,LIF 受容体 の siRNA ノックダウンは増殖を減少させる結果となった.これらの知見から,LIF は収縮誘発性のマイオカインであり,オートクラインかつまたはパラクライン様式でその効果を発揮してサテライト細胞増殖を誘導すると示唆されている.
IL‑15
IL-15 は IL-2 スーパーファミリーに属し,ヒト骨格筋で発現する.その骨格筋でのアナボリック効果に加えて,IL-15 は脂質代謝での役割を有する可能性がある (97). IL-15 は前脂肪細胞での脂質沈着を減少させ,脂肪組織全体の質量を減少させる (98,99). 結果として,ヒトにおいては IL-15 濃度と総脂肪量,体脂肪組織量および体脂肪率との間に負の相関が見出された (100).
運動不足は筋肉量喪失と内臓脂肪の蓄積につながり,いくつかのエビデンスは IL-15 が腹部肥満と関連していると指摘している.それを支持するように,我々はネズミの筋肉において IL-15 が過剰発現している際には皮下脂肪でなく内臓脂肪が減少することを証明した (100). しかし,IL-15 は脂肪-筋肉間のクロストークにおいて一部の役割を演じていることは示唆されているが,筋細胞からの IL-15 分泌は記述されておらず,ゆえに,IL-15 を真のマイオカインとして分類するには時期尚早である.
Other myokines
骨格筋特異的な世代は,Akt1 誘導型トランスジェニックマウス,つまり Akt1 シグナリングのスイッチをオンオフすることで可逆的に機能する II 型筋線維に成長できるのであるが,新しい筋分泌因子として同定された (101). 彼らはフォリスタチン関連蛋白 1 および FGF-21 (104) を誘導し,フォリスタチン関連蛋白 1 は心血管保護効果を有しているようであった (102,103). フォリスタチン関連蛋白 1 は,一酸化窒素合成酵素依存性の機序を通じて内皮細胞機能および虚血組織の再灌流を活性化する (102). ヒトでの研究が支持するところによると,FGF-21 はインスリンによりアップレギュレートされるマイオカインである (105). 他の筋細胞由来蛋白質には BDNF (106), カルプロテクチン (107), エリスロポイエチン (108) および IL-4 が含まれており,IL-4 は筋芽細胞の筋線維への融合を刺激して筋再生を促進する (109).
筋肉-骨相互作用におけるマイオカインの役割は,二つのよく知られた骨新生因子である IGF-1 および FGF-2 がホモジナイズされた筋組織で豊富に存在すること,および in vitro で培養された筋線維から分泌されることを元にして示唆されていた (110). これらの成長因子の受容体は筋肉と骨のインターフェースとして骨膜に局在しており (111), IGF-1 および FGF-21 が筋肉-骨のクロストークに関連している可能性を示唆している.
過去数年間で,アイリシンがマイオカインとして発見された.これは白色脂肪組織を褐色脂肪様に分化させるものである.PCG-1α の筋肉での発現は FNDC5 の発現の増加を示しており,それは切断されアイリシンとして分泌された膜蛋白をコードしている (112). FNDC5 を発現したアデノウイルス粒子を注射したマウスでは,それによりアイリシン濃度が 3 倍から 4 倍に増加し,白色脂肪組織の褐色脂肪細胞への分化プログラムが誘導され,付随してエネルギー支出が増加する結果となる.ヒトでは 10 週間の規則的な運動で血清アイリシン濃度の基礎値が増加し,これは運動へのトレーニング適応におけるアイリシンの役割を示唆している (112).
Bioinformatics and proteomic studies
ヒトの遺伝子配列の 10 % までが蛋白質を発現する能力があり,潜在的に細胞から分泌される可能性がある.そのような分泌因子は細胞間のコミュニケーションに関連する可能性があり,複雑な生命体における恒常性が要求される (22). 多くの研究班が筋細胞セクレトームの同定に寄与してきた.Bortoluzzi らは正常なヒト骨格筋細胞から 6,255 の遺伝子発現産物をスクリーニングした (17). 彼らは骨格筋のセクレトームは 319 の蛋白質を含むとの推定に至り,それには 78 のまだ性質の分かっていない蛋白質も含まれている.Yoon らは分化した L6 ラット骨格筋細胞を研究して全部で 254 の蛋白質を同定し,そのうち 153 が分泌蛋白質であると分類された (18). Henningsen らの研究では,定量的プロテオミクスプラットフォームが使用され,マウス C2C12 骨格筋細胞の分化の間に分泌される因子を調査した.全部で 635 の分泌蛋白質が同定された (19). 蛋白質の CC ケモカインファミリーの一員は分化の間の分泌において非常に明確なパターンを示した (113). Norheim らは全部で 236 の蛋白質が培養ヒト筋線維の条件付き培地におけるプロテオーム解析において検出されたと証明した (114). 健康なボランティアに 11 週間の筋力トレーニングを行わせた後,外側広筋およびまたは僧帽筋で 15 の筋分泌蛋白質が mRNA 発現を著明に増加させていたことが RT-PCR 解析により証明された.
Myokines: clinical aspect
同定された多くのマイオカインはその効果を筋肉自身の中で発揮する.ゆえに,ミオスタチン,LIF, IL-4, IL-6, IL-7 および IL-15 は筋肥大と筋形成に関連している.BDNF および IL-6 はAMPK 媒介性脂質酸化に関連しており,IL-8 (CXCL-1) はトレーニング誘発性血管新生に関連している可能性がある.しかし,IL-6 はまた全身効果をも示し,それには肝臓,脂肪組織および免疫系が含まれる.フォリスタチン関連蛋白 1 は内皮細胞機能と虚血ストレス状態下での再灌流を促進する役割を果たしていることが同定された.IGF-1 と FGF-21 は筋肉-骨のクロストークに関連していることがわかった.
マイオカイン分野は新しく,かつ,今日では,ヒトの研究では IL-6 の役割に最も焦点が当てられている.筋由来の IL-6 がいくつかの有益な代謝効果を有するとの知見は,運動不足のライフスタイルと慢性疾患のリスクの増加との関連を示唆している.Sadagurski らは,ヒト IL-6 の循環血中濃度が持続的に高値であるトランスジェニックマウスにおいて中心性レプチン作用が亢進しており,栄養素の恒常性が改善した結果,食事誘発性肥満からの保護に至ったと証明した (115). さらに,Wunderlich らはマウスでの正常な肝臓の代謝に IL-6 シグナリングが必要とされることを示した.注目すべきは,毛様体神経栄養因子がサイトカイン IL-6 ファミリーの一員であり,高脂肪食 (70) や脂質注射でインスリン抵抗性誘発されたマウスでさえ代謝の恒常性を改善することである (117). 興味深いことに,毛様体神経栄養因子の変異体である axokine は臨床試験において 2 型糖尿病治療に用いられたが,効果を中和する抗体が存在しないことを理由に承認されなかった (118). にもかかわらず,運動が複数の有益な効果を有するとの知見はマイオカインにより媒介されるものであり,マイオカイン研究の治療における潜在的な可能性を示唆している.
AMPK 活性化を経由してのインスリン感受性周辺のマイオカインの効果とは別に,マイオカインが膵臓 β 細胞の代謝およびインスリン分泌において主要な役割を果たしている可能性があるとのエビデンスが出現している.Bouzakri らはヒト筋線維がマイオカインの異なるパネルを発現し放出し,それはインスリン感受性に依存しており,それぞれのパネルが膵臓 β 細胞において異なる効果を発揮していると示した (119). さらに,Ellinsgaard らは,運動が正常マウスでは耐糖能を増加させる一方で,この現象は IL-6 全欠損マウスでは起こらないことを示した (120). いくつかの優秀なモデルを用いて,研究者たちは運動誘発性 GLP-1 反応が筋由来 IL-6 に依存することを示すことが可能となった.ゆえに,IL-6 は二つの異なるインスリン感受性をもつ組織間でのクロストークを媒介する.つまり腸管と膵島であるが,GLP-1 分泌増加によるインスリン需要の変化に適応するためである.
疫学研究は女性の座位の生活スタイルでの乳癌リスク増大を示唆しており,一方で規則的な運動は乳癌の進行に対して保護効果がある (121). 運動が乳癌細胞増殖を阻害する何らかの効果を一つまたはいくつかのマイオカインが媒介する可能性があるとのエビデンスが存在し,可能性のある候補はオンコスタチン M であり,Il-6 スーパーファミリーの一員である (122).
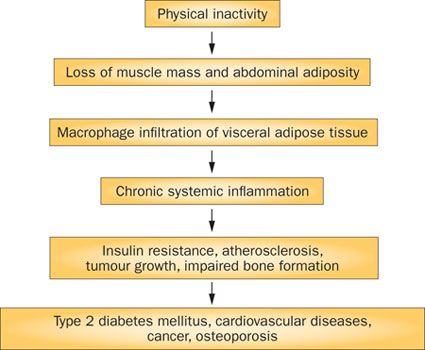
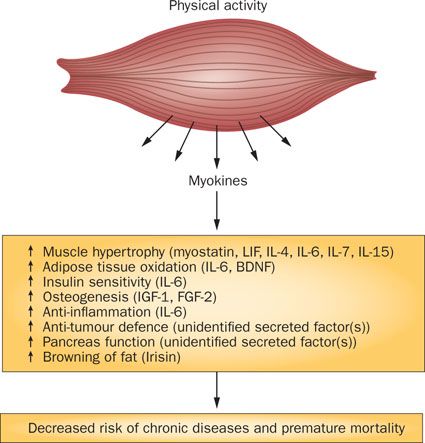
要約すると,運動不足と筋廃用は筋肉量喪失と内臓脂肪組織の蓄積に至り,その結果として炎症性経路のネットワークを活性化させ,インスリン抵抗性,動脈硬化,神経変性と腫瘍増大を促進し,ゆえに,慢性疾患のクラスターの進展を促進することになる (Figure 3) (21). 対照的に,筋肉がマイオカイン産生し放出するとの知見は,運動がいかにして早期死亡から保護するかの理解について分子レベルでの基礎を提供している (Figure 4).
Conclusions
筋肉は体内で最大の臓器であることから,筋肉のセクレトームの同定は科学のコミュニティにとって新しい議題の設定を可能にした.骨格筋は分泌臓器であるとの観点は,筋肉がいかにして他の臓器,つまり脂肪組織,肝臓,膵臓,骨および脳と対話するかを理解するための概念的基礎を提供してくれる.運動不足や筋肉を使用しないことは潜在的にマイオカイン反応の障害や変化にいたり,かつまたはマイオカイン抵抗性は,なぜ運動の欠落が心血管疾患,2 型糖尿病,腫瘍および骨粗鬆症を含む疾病ネットワーク全体のリスクを増やすのかを説明する.
References
1. Cook, K. S. et al. Adipsin: a circulating serine protease homolog secreted by adipose tissue and sciatic nerve. Science 237, 402–405 (1987).
2. Zhang, Y. et al. Positional cloning of the mouse obese gene and its human homologue. Nature 372, 425–432 (1994).
3. Scherer, P. E. Adipose tissue: from lipid storage compartment to endocrine organ. Diabetes 55, 1537–1545 (2006).
4. Shetty, S., Kusminski, C. M. & Scherer, P. E. Adiponectin in health and disease: evaluation of adiponectin-targeted drug development strategies. Trends Pharmacol. Sci. 30, 234–239 (2009).
5. Olsen, R. H., Krogh-Madsen, R., Thomsen, C., Booth, F. W. & Pedersen, B. K. Metabolic responses to reduced daily steps in healthy nonexercising men. JAMA 299, 1261–1263 (2008).
6. Krogh-Madsen, R. et al. A 2 wk reduction of ambulatory activity attenuates peripheral insulin sensitivity. J. Appl. Physiol. 108, 1034–1040 (2010).
7. Booth, F. W., Chakravarthy, M. V., Gordon, S. E. & Spangenburg, E. E. Waging war on physical inactivity: using modern molecular ammunition against an ancient enemy. J. Appl. Physiol. 93, 3–30 (2002).
8. Tuomilehto, J. et al. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N. Engl. J. Med. 344, 1343–1350 (2001).
9. Nocon, M. et al. Association of physical activity with all-cause and cardiovascular mortality: a systematic review and meta-analysis. Eur. J. Cardiovasc. Prev. Rehabil. 15, 239–246 (2008).
10. Wolin, K. Y., Yan, Y., Colditz, G. A. & Lee, I. M. Physical activity and colon cancer prevention: a meta-analysis. Br. J. Cancer 100, 611–616 (2009).
11. Monninkhof, E. M. et al. Physical activity and breast cancer: a systematic review. Epidemiology 18, 137–157 (2007).
12. Borer, K. T. Physical activity in the prevention and amelioration of osteoporosis in women: interaction of mechanical, hormonal and dietary factors. Sports Med. 35, 779–830 (2005).
13. Goldstein, M. S. Humoral nature of the hypoglycemic factor of muscular work. Diabetes 10, 232–234 (1961).
14. Pedersen, B. K. et al. Searching for the exercise factor: is IL 6 a candidate? J. Muscle Res. Cell Motil. 24, 113–119 (2003).
15. Kjaer, M. et al. Hormonal and metabolic responses to electrically induced cycling during epidural anesthesia in humans. J. Appl. Physiol. 80, 2156–2162 (1996).
16. Mohr, T. et al. Long-term adaptation to electrically induced cycle training in severe spinal cord injured individuals. Spinal Cord 35, 1–16 (1997).
17. Bortoluzzi, S., Scannapieco, P., Cestaro, A., Danieli, G. A. & Schiaffino, S. Computational reconstruction of the human skeletal muscle secretome. Proteins 62, 776–792 (2006).
18. Yoon, J. H. et al. Comparative proteomic analysis of the insulin-induced L6 myotube secretome. Proteomics 9, 51–60 (2009).
19. Henningsen, J., Rigbolt, K. T., Blagoev, B., Pedersen, B. K. & Kratchmarova, I. Dynamics of the skeletal muscle secretome during myoblast differentiation. Mol. Cell. Proteomics 9, 2482–2496 (2010).
20. Long, A., Donelson, R. & Fung, T. Does it matter which exercise? A randomized control trial of exercise for low back pain. Spine (Phila. Pa. 1976) 29, 2593–2602 (2004).
21. Pedersen, B. K. The diseasome of physical inactivity–and the role of myokines in muscle-fat cross talk. J. Physiol. 587, 5559–5568 (2009).
22. Walsh, K. Adipokines, myokines and cardiovascular disease. Circ. J. 73, 13–18 (2009).
23. Pedersen, B. K. & Febbraio, M. A. Muscle as an endocrine organ: focus on muscle-derived interleukin 6. Physiol. Rev. 88, 1379–1406 (2008).
24. Pedersen, B. K., Akerström, T. C., Nielsen, A. R. & Fischer, C. P. Role of myokines in exercise and metabolism. J. Appl. Physiol. 103, 1093–1098 (2007).
25. Pedersen, B. K. The anti-inflammatory effect of exercise: its role in diabetes and cardiovascular disease control. Essays Biochem. 42, 105–117 (2006).
26. McPherron, A. C., Lawler, A. M. & Lee, S. J. Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member. Nature 387, 83–90 (1997).
27. Rodgers, B. D. & Garikipati, D. K. Clinical, agricultural, and evolutionary biology of myostatin: a comparative review. Endocr. Rev. 29, 513–534 (2008).
28. Allen, D. L. et al. Myostatin, activin receptor IIb, and follistatin like 3 gene expression are altered in adipose tissue and skeletal muscle of obese mice. Am. J. Physiol. Endocrinol. Metab. 294, E918–E927 (2008).
29. Feldman, B. J., Streeper, R. S., Farese, R. V. Jr & Yamamoto, K. R. Myostatin modulates adipogenesis to generate adipocytes with favorable metabolic effects. Proc. Natl Acad. Sci. USA 103, 15675–15680 (2006).
30. Guo, T. et al. Myostatin inhibition in muscle, but not adipose tissue, decreases fat mass and improves insulin sensitivity. PLoS ONE 4, e4937 (2009).
31. Zhao, B., Wall, R. J. & Yang, J. Transgenic expression of myostatin propeptide prevents diet-induced obesity and insulin resistance. Biochem. Biophys. Res. Commun. 337, 248–255 (2005).
32. Lin, J. et al. Myostatin knockout in mice increases myogenesis and decreases adipogenesis. Biochem. Biophys. Res. Commun. 291, 701–706 (2002).
33. McPherron, A. C. & Lee, S. J. Suppression of body fat accumulation in myostatin-deficient mice. J. Clin. Invest. 109, 595–601 (2002).
34. Allen, D. L., Hittel, D. S. & McPherron, A. C. Expression and function of myostatin in obesity, diabetes, and exercise adaptation. Med. Sci. Sports Exerc. 43, 1828–1835 (2011).
35. Hittel, D. S., Berggren, J. R., Shearer, J., Boyle, K. & Houmard, J. A. Increased secretion and expression of myostatin in skeletal muscle from extremely obese women. Diabetes 58, 30–38 (2009).
36. Hansen, J. et al. Exercise induces a marked increase in plasma follistatin: evidence that follistatin is a contraction-induced hepatokine. Endocrinology 152, 164–171 (2011).
37. Fischer, C. P. Interleukin 6 in acute exercise and training: what is the biological relevance? Exerc. Immunol. Rev. 12, 6–33 (2006).
38. De Rossi, M., Bernasconi, P., Baggi, F., de Waal Malefyt, R. & Mantegazza, R. Cytokines and chemokines are both expressed by human myoblasts: possible relevance for the immune pathogenesis of muscle inflammation. Int. Immunol. 12, 1329–1335 (2000).
39. Bartoccioni, E., Michaelis, D. & Hohlfeld, R. Constitutive and cytokine-induced production of interleukin 6 by human myoblasts. Immunol. Lett. 42, 135–138 (1994).
40. Keller, C., Hellsten, Y., Steensberg, A. & Pedersen, B. K. Differential regulation of IL 6 and TNF-alpha via calcineurin in human skeletal muscle cells. Cytokine 36, 141–147 (2006).
41. Serrano, A. L., Baeza-Raja, B., Perdiguero, E., Jardí, M. & Muñoz-Cánoves, P. Interleukin 6 is an essential regulator of satellite cell-mediated skeletal muscle hypertrophy. Cell Metab. 7, 33–44 (2008).
42. Haugen, F. et al. IL 7 is expressed and secreted by human skeletal muscle cells. Am. J. Physiol. Cell Physiol. 298, C807–C816 (2010).
43. Green, C. J., Pedersen, M., Pedersen, B. K. & Scheele, C. Elevated NF κB activation is conserved in human myocytes cultured from obese type 2 diabetic patients and attenuated by AMP-activated protein kinase. Diabetes 60, 2810–2819 (2011).
44. Nieman, D. C. et al. Influence of mode and carbohydrate on the cytokine response to heavy exertion. Med. Sci. Sports Exerc. 30, 671–678 (1998).
45. Nehlsen-Cannarella, S. L. et al. Carbohydrate and the cytokine response to 2.5h of running. J. Appl. Physiol. 82, 1662–1667 (1997).
46. Ullum, H. et al. Bicycle exercise enhances plasma IL 6 but does not change IL 1 alpha, IL 1 beta, IL 6, or TNF-alpha pre-mRNA in BMNC. J. Appl. Physiol. 77, 93–97 (1994).
47. Starkie, R. L., Angus, D. J., Rolland, J., Hargreaves, M. & Febbraio, M. Effect of prolonged, submaximal exercise and carbohydrate ingestion on monocyte intracellular cytokine production in humans. J. Physiol. 528, 647–655 (2000).
48. Starkie, R. L., Rolland, J., Angus, D. J., Anderson, M. J. & Febbraio, M. A. Circulating monocyes are not the source of elevations in plasma IL 6 and TNF-alpha levels after prolonged running. Am. J. Physiol. Cell Physiol. 280, C769–C774 (2001).
49. Febbraio, M. A. et al. Hepatosplanchnic clearance of interleukin 6 in humans during exercise. Am. J. Physiol. Endocrinol. Metab. 285, E397–E402 (2003).
50. Keller, C. et al. Transcriptional activation of the IL 6 gene in human contracting skeletal muscle: influence of muscle glycogen content. FASEB J. 15, 2748–2750 (2001).
51. Steensberg, A. et al. IL 6 and TNF-alpha expression in, and release from, contracting human skeletal muscle. Am. J. Physiol. Endocrinol. Metab. 283, E1272–E1278 (2002).
52. Hiscock, N., Chan, M. H., Bisucci, T., Darby, I. A. & Febbraio, M. A. Skeletal myocytes are a source of interleukin 6 mRNA expression and protein release during contraction: evidence of fiber type specificity. FASEB J. 18, 992–994 (2004).
53. Rosendal, L. et al. Increase in interstitial interleukin 6 of human skeletal muscle with repetitive low-force exercise. J. Appl. Physiol. 98, 477–481 (2005).
54. Steensberg, A. et al. Production of interleukin 6 in contracting human skeletal muscles can account for the exercise-induced increase in plasma interleukin 6. J. Physiol. 529, 237–242 (2000).
55. Keller, C. et al. Effect of exercise, training, and glycogen availability on IL 6 receptor expression in human skeletal muscle. J. Appl. Physiol. 99, 2075–2079 (2005).
56. Steensberg, A. et al. Interleukin 6 production in contracting human skeletal muscle is influenced by pre-exercise muscle glycogen content. J. Physiol. 537, 633–639 (2001).
57. Pedersen, B. K. Muscular IL 6 and its role as an energy sensor. Med. Sci. Sports Exerc. 44, 392–396 (2012).
58. Ruderman, N. B. et al. Interleukin 6 regulation of AMP-activated protein kinase. Potential role in the systemic response to exercise and prevention of the metabolic syndrome. Diabetes 55 (Suppl. 2), S48–S54 (2006).
59. Pedersen, B. K. et al. The metabolic role of IL 6 produced during exercise: is IL 6 an exercise factor? Proc. Nutr. Soc. 63, 263–267 (2004).
60. Hoene, M. & Weigert, C. The role of interleukin 6 in insulin resistance, body fat distribution and energy balance. Obes. Rev. 9, 20–29 (2008).
61. Febbraio, M. A. et al. Glucose ingestion attenuates interleukin 6 release from contracting skeletal muscle in humans. J. Physiol. 549, 607–612 (2003).
62. Phillips, S. M. et al. Effects of training duration on substrate turnover and oxidation during exercise. J. Appl. Physiol. 81, 2182–2191 (1996).
63. Fischer, C. P. et al. Endurance training reduces the contraction-induced interleukin 6 mRNA expression in human skeletal muscle. Am. J. Physiol. Endocrinol. Metab. 287, E1189–E1194 (2004).
64. Carey, A. L. et al. Interleukin 6 increases insulinstimulated glucose disposal in humans and glucose uptake and fatty acid oxidation in vitro via AMP-activated protein kinase. Diabetes 55, 2688–2697 (2006).
65. Bruce, C. R. & Dyck, D. J. Cytokine regulation of skeletal muscle fatty acid metabolism: effect of interleukin 6 and tumor necrosis factor-alpha. Am. J. Physiol. Endocrinol. Metab. 287, E616–E621 (2004).
66. Petersen, E. W. et al. Acute IL 6 treatment increases fatty acid turnover in elderly humans in vivo and in tissue culture in vitro. Am. J. Physiol. 288, E155–E162 (2005).
67. van Hall, G. et al. Interleukin 6 stimulates lipolysis and fat oxidation in humans. J. Clin. Endocrinol. Metab. 88, 3005–3010 (2003).
68. Kahn, B. B., Alquier, T., Carling, D. & Hardie, D. G. AMP-activated protein kinase: ancient energy gauge provides clues to modern understanding of metabolism. Cell Metab. 1, 15–25 (2005).
69. Minokoshi, Y. et al. Leptin stimulates fatty-acid oxidation by activating AMP-activated protein kinase. Nature 415, 339–343 (2002).
70. Watt, M. J. et al. CNTF reverses obesity-induced insulin resistance by activating skeletal muscle AMPK. Nat. Med. 12, 541–548 (2006).
71. Steinberg, G. R., Rush, J. W. & Dyck, D. J. AMPK expression and phosphorylation are increased in rodent muscle after chronic leptin treatment. Am. J. Physiol. Endocrinol. Metab. 284, E648–E654 (2003).
72. Steinberg, G. R., Watt, M. J. & Febbraio, M. A. Cytokine Regulation of AMPK signalling. Front. Biosci. 14, 1902–1916 (2009).
73. Wallenius, V. et al. Interleukin 6 deficient mice develop mature-onset obesity. Nat. Med. 8, 75–79 (2002).
74. Febbraio, M. A., Hiscock, N., Sacchetti, M., Fischer, C. P. & Pedersen, B. K. Interleukin 6 is a novel factor mediating glucose homeostasis during skeletal muscle contraction. Diabetes 53, 1643–1648 (2004).
75. Steensberg, A. et al. Acute interleukin 6 administration does not impair muscle glucose uptake or whole-body glucose disposal in healthy humans. J. Physiol. 548, 631–638 (2003).
76. Lyngsø, D., Simonsen, L. & Bülow, J. Interleukin 6 production in human subcutaneous abdominal adipose tissue: the effect of exercise. J. Physiol. 543, 373–378 (2002).
77. Wolsk, E., Mygind, H., Grøndahl, T. S., Pedersen, B. K. & van Hall, G. IL 6 selectively stimulates fat metabolism in human skeletal muscle. Am. J. Physiol. Endocrinol. Metab. 299, E832 E840 (2010).
78. Nielsen, S. & Pedersen, B. K. Skeletal muscle as an immunogenic organ. Curr. Opin. Pharmacol. 8, 346–351 (2008).
79. Petersen, A. M. & Pedersen, B. K. The antiinflammatory effect of exercise. J. Appl. Physiol. 98, 1154–1162 (2005).
80. Schindler, R. et al. Correlations and interactions in the production of interleukin 6 (IL 6), IL 1, and tumor necrosis factor (TNF) in human blood mononuclear cells: IL 6 suppresses IL 1 and TNF. Blood 75, 40–47 (1990).
81. Mizuhara, H. et al. T cell activation-associated hepatic injury: mediation by tumor necrosis factors and protection by interleukin 6. J. Exp. Med. 179, 1529–1537 (1994).
82. Starkie, R., Ostrowski, S. R., Jauffred, S., Febbraio, M. & Pedersen, B. K. Exercise and IL 6 infusion inhibit endotoxin-induced TNF-alpha production in humans. FASEB J. 17, 884–886 (2003).
83. Steensberg, A., Fischer, C. P., Keller, C., Møller, K. & Pedersen, B. K. IL 6 enhances plasma IL 1ra, IL 10, and cortisol in humans. Am. J. Physiol. Endocrinol. Metab. 285, E433–E437 (2003).
84. Rubio, N. & Sanz-Rodriguez, F. Induction of the CXCL1 (KC) chemokine in mouse astrocytes by infection with the murine encephalomyelitis virus of Theiler. Virology 358, 98–108 (2007).
85. Lira, S. A. et al. Expression of the chemokine N51/KC in the thymus and epidermis of transgenic mice results in marked infiltration of a single class of inflammatory cells. J. Exp. Med. 180, 2039–2048 (1994).
86. Keane, M. P. et al. The CXC chemokines, IL 8 and IP 10, regulate angiogenic activity in idiopathic pulmonary fibrosis. J. Immunol. 159, 1437–1443 (1997).
87. Belperio, J. A. et al. CXC chemokines in angiogenesis. J. Leukoc. Biol. 68, 1–8 (2000).
88. Addison, C. L. et al. The CXC chemokine receptor 2, CXCR2, is the putative receptor for ELR+ CXC chemokine-induced angiogenic activity. J. Immunol. 165, 5269–5277 (2000).
89. Tseng, Y. L., Wu, M. H., Yang, H. C., Wang, C. Y. & Lin, C. F. Autocrine IL 6 regulates GRO-alpha production in thymic epithelial cells. Cytokine 51, 195–201 (2010).
90. Pedersen, L. et al. Exercise-induced liver CXCL 1 expression is linked to muscle derived interleukin-6 expression. J. Physiol. 589, 1409–1420 (2011).
91. Nieman, D. C. et al. Muscle cytokine mRNA changes after 2.5h of cycling: influence of carbohydrate. Med. Sci. Sports Exerc. 37, 1283–1290 (2005).
92. Hilton, D. J., Nicola, N. A. & Metcalf, D. Purification of a murine leukemia inhibitory factor from Krebs ascites cells. Anal. Biochem. 173, 359–367 (1988).
93. Heinrich, P. C., Behrmann, I., Müller-Newen, G., Schaper, F. & Graeve, L. Interleukin-6-type cytokine signalling through the gp130/Jak/STAT pathway. Biochem. J. 334, 297–314 (1998).
94. Metcalf, D. The unsolved enigmas of leukemia inhibitory factor. Stem Cells 21, 5–14 (2003).
95. Broholm, C. & Pedersen, B. K. Leukaemia inhibitory factor—an exercise-induced myokine. Exerc. Immunol. Rev. 16, 77–85 (2010).
96. Broholm, C. et al. Exercise induces expression of leukaemia inhibitory factor in human skeletal muscle. J. Physiol. 586, 2195–2201 (2008).
97. Nielsen, A. R. & Pedersen, B. K. The biological roles of exercise-induced cytokines: IL 6, IL 8, and IL 15. Appl. Physiol. Nutr. Metab. 32, 833–839 (2007).
98. Carbó, N. et al. Interleukin 15 mediates reciprocal regulation of adipose and muscle mass: a potential role in body weight control. Biochim. Biophys. Acta 1526, 17–24 (2001).
99. Quinn, L. S., Strait-Bodey, L., Anderson, B. G., Argilés, J. M. & Havel, P. J. Interleukin 15 stimulates adiponectin secretion by 3T3 L1 adipocytes: evidence for a skeletal muscle to fat signaling pathway. Cell Biol. Int. 29, 449–457 (2005).
100.Nielsen, A. R. et al. Association between IL 15 and obesity: IL 15 as a potential regulator of fat mass. J. Clin. Endocrinol. Metab. 93, 4486–4493 (2008).
101.Izumiya, Y. et al. Fast/Glycolytic muscle fiber growth reduces fat mass and improves metabolic parameters in obese mice. Cell Metab. 7, 159–172 (2008).
102.Ouchi, N. et al. Follistatin-like 1, a secreted muscle protein, promotes endothelial cell function and revascularization in ischemic tissue through a nitric-oxide synthase-dependent mechanism. J. Biol. Chem. 283, 32802–32811 (2008).
103.Oshima, Y. et al. Follistatin-like 1 is an Aktregulated cardioprotective factor that is secreted by the heart. Circulation 117, 3099–3108 (2008).
104.Izumiya, Y. et al. FGF21 is an Akt-regulated myokine. FEBS Lett. 582, 3805–3810 (2008).
105.Hojman, P. et al. Fibroblast growth factor 21 is induced in human skeletal muscles by hyperinsulinemia. Diabetes 58, 2797–2801 (2009).
106.Pedersen, B. K. et al. Role of exercise-induced brain-derived neurotrophic factor production in the regulation of energy homeostasis in mammals. Exp. Physiol. 94, 1153–1160 (2009).
107.Mortensen, O. H. et al. Calprotectin is released from human skeletal muscle tissue during exercise. J. Physiol. 586, 3551–3562 (2008).
108.Hojman, P. et al. Erythropoietin over-expression protects against diet-induced obesity in mice through increased fat oxidation in muscles. PLoS ONE 4, e5894 (2009).
109.Horsley, V., Jansen, K. M., Mills, S. T. & Pavlath, G. K. IL 4 acts as a myoblast recruitment factor during mammalian muscle growth. Cell 113, 483–494 (2003).
110.Hamrick, M. W. A role for myokines in musclebone interactions. Exerc. Sport Sci. Rev. 39, 43–47 (2011).
111.Hamrick, M. W., McNeil, P. L. & Patterson, S. L. Role of muscle-derived growth factors in bone formation. J. Musculoskelet. Neuronal Interact. 10, 64–70 (2010).
112.Boström, P. et al. A PGC1-α dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature 481, 463–468 (2012).
113.Henningsen, J., Pedersen, B. K. & Kratchmarova, I. Quantitative analysis of the secretion of the MCP family of chemokines by muscle cells. Mol. Biosyst. 7, 311–321 (2011).
114.Norheim, F. et al. Proteomic identification of secreted proteins from human skeletal muscle cells and expression in response to strength training. Am. J. Physiol. Endocrinol. Metab. 301, E1013–E1021 (2011).
115.Sadagurski, M. et al. Human IL6 enhances leptin action in mice. Diabetologia 53, 525–535 (2010).
116.Wunderlich, F. T. et al. Interleukin 6 signaling in liver-parenchymal cells suppresses hepatic inflammation and improves systemic insulin action. Cell Metab. 12, 237–249 (2010).
117.Watt, M. J., Hevener, A., Lancaster, G. I. & Febbraio, M. A. Ciliary neurotrophic factor prevents acute lipid-induced insulin resistance by attenuating ceramide accumulation and phosphorylation of c Jun N terminal kinase in peripheral tissues. Endocrinology 147, 2077–2085 (2006).
118.Ettinger, M. P. et al. Recombinant variant of ciliary neurotrophic factor for weight loss in obese adults: a randomized, dose-ranging study. JAMA 289, 1826–1832 (2003).
119.Bouzakri, K. et al. Bimodal effect on pancreatic [beta] cells of secretory products from normal or insulin-resistant human skeletal muscle. Diabetes 60, 1111–1121 (2011).
120.Ellingsgaard, H. et al. Interleukin 6 enhances insulin secretion by increasing glucagon-like peptide 1 secretion from L cells and alpha cells. Nat. Med. 17, 1481–1489 (2011).
121.Food, Nutrition, Physical Activity and the Prevention of Cancer. World Cancer Research Fund and American Institute of Cancer Research. Ref. Type: Report (2007).
122.Hojman, P. et al. Exercise-induced musclederived cytokines inhibit mammary cancer cell growth. Am. J. Physiol. Endocrinol. Metab. 301, E504–E510 (2011).
