低強度と高強度との筋力トレーニングにおける筋力と筋肥大の適応,システマティックレビューとメタアナリシスにおいて参考文献の一つに挙げられていた論文を抄訳する.ロシアからの筋生検を含む貴重な報告である.このような侵襲的な検査は旧共産圏だから可能なのかも知れない.
トレーニング負荷の軽重の違いで肥大する筋繊維の型が異なる,という引用だけを抜粋するつもりだったのが,筋形成調節遺伝子にまで言及しており,ほぼ全訳となってしまった.二週間もかかってしまうのでは効率が悪すぎるのだが,ここは勉強と思って我慢しよう.
Optimization of Training: New Developments in Safe Strength Training (Human Physiology, 2013, Vol. 39, No. 5, pp. 511–523)
Abstract
The hypertrophic effect of strength training is known to be due to mechanical and metabolic stimuli. During exercises with the restricted blood supply of working muscles, i.e., under the conditions of intensified metabolic stress, the training effect may be achieved with much lower external loads (20% of one repetition maximum). The effects of 8 weeks of high intensity (80–85% of one repetition maximum) strength training were compared to low intensity (50% of one repetition maximum) training without relaxation. The high intensity strength training resulted in higher increases in strength and size of the exercised muscles than training without relaxation. During high intensity training, at the muscle cross section, an increase in the area occupied by type II fibers prevails; while, during training without relaxation, an increase in the area occupied by type I fibers prevails. An exercise session without relaxation leads to a more pronounced increase in the secretion of the growth hormone, insulin like growth factor 1, and cortisol. The expression of gene regulating myogenesis (Myostatin) is changed in different ways after a high intensity strength exercise session and after an exercise session without relaxation. Low intensity strength training (50% of one repetition maximum) without relaxation is an efficient way for inducing increases of the strength and size of the trained muscles. This low intensive type of training may be used in rehabilitation medicine, sports, and fitness.
筋力トレーニングの肥大効果は機械的刺激および代謝的刺激によることが知られている.血液の供給を制限した運動中,例えば代謝ストレスの強化された条件下などでは,トレーニング効果はより極端に低い外部負荷 (20% 1RM) において達成される可能性がある.8 週間の高強度筋力トレーニング (80-85% 1RM) の効果と弛緩なしの低強度筋力トレーニング (50% 1RM) の効果とを比較した.高強度トレーニングは弛緩なしのトレーニングよりも筋力および運動した筋肉の大きさにおいてより高い増加をもたらした.高強度トレーニングの間,筋断面積においては II 型線維の面積が優先的に増加した.一方で,弛緩なしのトレーニングの間は I 型線維の面積が優先的に増加した.弛緩なしの運動セッションでは成長ホルモン,IGF-1 およびコルチゾールの分泌がより顕著に増加する.筋形成調節遺伝子(ミオスタチン)は,高強度筋力トレーニングの後と弛緩なしの低強度筋力トレーニングの後とでは,異なる経路で発現する.弛緩なしの低強度筋力トレーニング (50% 1RM) はトレーニングした筋肉の筋力と大きさを増加させる効果的な方法である.この低強度型のトレーニングはリハビリテーション医学,スポーツおよびフィットネスに活用しうる.
Keywords
strength training, skeletal muscle, muscle fibers, anabolic hormones, gene expression
MATERIALS AND METHODS
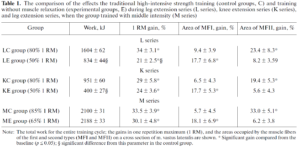
8-10 週間の期間で高強度群として 80-85% 1RM および,低強度群として 50-70% 1RM 弛緩なしとし,種目はレッグエクステンション(L シリーズ)とニーエクステンション(K シリーズ),筋肉の形態学的変化を計測するのに MRI を用い,生化学的検査および内分泌学的検査,さらに筋生検を施行した.
I 型および II 型筋線維 (MFI, MFII) により占められる面積は外側広筋の断面,つまり筋肉内のこの型の線維の組成の割合にこの型の筋線維断面積をかけて求めた.
採血検査は初期(第 2 週)および後期(第 7 週)に施行した.比較のためベースラインの休息時とトレーニングの 1 セッション後に採血した.項目は乳酸,成長ホルモン (GH), インスリン様成長因子 (IGF-1), テストステロンおよびコルチゾールである.トレーニングセッション前と 18 時間後に血清クレアチンキナーゼ活性 (CK), 心筋アイソフォーム (CK-MB) を測定した.横紋筋由来の CK (CK-MM) は計算で求めた.
筋形成調節遺伝子の発現の変化は 1 セッション前, 5 時間後, 22 時間後に行い,リアルタイム PCR 法を用いた.
ワークアウト当日は被験者は通常の朝食を摂って 1 時間後にトレーニングセッションを行い,通常の昼食を摂った.トレーニング前と 15 分後に静脈血を採血してホルモン値を測定した.3 セット後,5 セット後,8 セット後に指の毛細血管から採血して乳酸値とグルコース濃度を測定した.トレーニング前,5 時間後,22 時間後に micro-biopsy technique を用いて外側広筋の筋組織標本を採取した.
筋肉の形態計測パラメータを推定するのに大腿四頭筋と大殿筋を MRI で計測した.
I 型および II 型筋線維の断面積を外側広筋の needle biopsy technique (29) により筋生検標本横断面を評価した.分析前に -20 °C でマイクロトームを用いて厚さ 5 µm に凍結切片に薄切し,筋線維に沿って連続切片を垂直に積み上げた.I 型および II 型筋線維は NCL-MHCf (a+b) および NCL-MHCs モノクローナル抗体 (Novocastra laboratories) を用いた免疫組織化学染色により検出した.そして,FITS で標識した二次抗体を用いた.計測はカールツァイス製 Axiovert-200 顕微鏡で行った.各々の組織標本につき,それぞれの型につき最低 100 の筋線維を計測した.
筋組織からの RNA 単離は米国 Invitrogen 製の TRIZOL セットにて行った.相補的 DNA はロシア製 Sileks セットにて得た.
ポリメラーゼ連鎖反応.リアルタイム PCR 法はロシア Synthol 製の SybrGreen セットにて行った.標本中のインスリン様成長因子 (IGF-1Ea) およびミオスタチンの遺伝子発現量を検出した.参照遺伝子としてリボゾームタンパク P0 および β アクチンを用いた.標的遺伝子の発現量変化は文献 30 に従って検出し,標的遺伝子と参照遺伝子の反応効率は標準曲線により計算した.
RESULTS AND DISCUSSION
Strength training of the leg extensors (L series)
両者の型の筋線維は高強度の筋収縮に関与している (32). 同時に次の点もよく知られている.つまり,伝統的な筋力トレーニングは I 型筋線維よりも II 型筋線維において激しい肥大をもたらす (33,34,35,36). おそらく,その理由は高強度の筋肉の仕事が II 型筋線維において I 型筋線維よりも明白な代謝性変化をもたらすためであろう.これにより mTORC1 および ERK1/2 シグナル経路のより大きな活性化がもたらされ,タンパク合成を調整する (37,38). 我々の試験 (39) においては LC 群(レッグエクステンション高強度群)において,作動筋である外側広筋における II 型筋線維の占める面積の増加は 23 % であった.一方で I 型筋線維については変化はなく,そのことは文献のデータとも一致する.しかし,弛緩なしの低強度筋力トレーニングの後に,定性的な差異の変化が以下のパラメータにおいて認められた.すなわち,II 型筋線維の占める面積には変化がなかった一方で,I 型筋線維の占める面積が 18 % 増加していた (Table 1). 我々は次のように仮定した.つまり,筋線維においてマークした代謝ストレスが,筋肥大のプロセスを開始させる因子の一つになりうるのではないかと.I 型筋線維においてマークした代謝シフトを達成するのは難しい (40). というのも,この型の筋線維は高い酸化電位を有しているからである.しかし以下のことが明らかになった.つまり,等尺性収縮(筋緊張による血流阻害条件下)において,25%, 50%, 75% 1RM の強度で外側広筋が疲労困憊した時の最大乳酸濃度を記録すると,50% 1 RM の時に I 型筋線維における乳酸濃度が最大となった (41,42). 明らかにこれは以下の事実によるものである.つまり,dimension の原理によると,この特徴の仕事は主に I 型筋線維が従事しているに違いなく (32), それはつまり,血流制限によるものであり,解糖系の活性化が起きていることによる.このことは次の想定の土台となる.つまり,弛緩なしの 50% 1RM の低強度トレーニングでは,等尺性運動と同様に,I 型筋線維が実行に関与しており,疲労困憊に至る時にマークした代謝シフトが観測される.特筆すべきことだが,LE 群においては各セットの終了は被験者の作動筋のひどい疲労に付随したものであった.と同時に,解糖系活性化のマーカーである血中乳酸濃度は LE 群のセッションでは LC 群よりも高い値を示した.
Strength training of the knee extensors (K series)
80-85% 1RM (対照群, KC 群)の強度による伝統的筋力トレーニングの効果を弛緩なしの 50% 1RM 低強度トレーニング群(介入群, KE 群)と比較した.10 週間のトレーニングサイクル期間における KC 群と KE 群の総仕事量の違いは 2 倍以上になった (Table 1). 同時に,膝伸展筋の 1RM の増加に違いは見られず, KC 群と KE 群でそれぞれ 29%, 24% であった (Table 1).
トレーニング期間における 1RM 増加の解析では L シリーズと K シリーズで有意差が認められた.K シリーズでは伝統的筋力トレーニング後の 1RM の増加は弛緩なしの低強度トレーニングよりも著明に大きかった (35% vs. 21%). 一方で K シリーズにおいては記録された群間に差異は認められなかった (29% vs. 24%). 明らかに,これらの違いは上述した下肢と膝の筋肉の生体力学的特徴,すなわち,筋肉間の負荷の再分配に関連している.
10 週間にわたる膝伸展筋トレーニングで,外側広筋断面積に占める異なる型の筋線維の面積を評価すると, KC 群での II 型筋線維と KE 群の I 型筋線維とは似たような増加を示しているのが分かる (Table 1). これは L シリーズのトレーニングでも観測された結果によく合致する.
ゆえに,膝と下肢伸展筋の長期トレーニングの効果の比較をもとに,我々は次のように結論付けた.(1) レッグエクステンションにおける膝伸展筋と臀部伸展筋の肥大の程度は運動の生体力学に依存する. (2) 筋肉間の負荷の再分配の結果として,弛緩なしの低強度でのレッグエクステンションにおける筋力増加は伝統的筋力トレーニングよりも劣る. (3) 膝伸展筋のトレーニングの例として,弛緩なし低強度トレーニングが伝統的筋力トレーニングと同等の膝伸展筋の筋力増加に至った例もある. (4) 膝伸展筋の弛緩なし低強度トレーニングは,レッグエクステンション同様,筋力増加をもたらし,それは主に I 型筋線維の肥大による.
Strength training of medium-intensity without relaxation (M series)
(略)
An increase in the muscle mass and strength during low-intensity training without relaxation is related to hormonal adaptation
上述したように,筋肥大は機械的および代謝的因子により活性化される.両者の因子は,筋線維に作用して直接的か,または同化ホルモンの分泌増加を介して間接的にタンパク合成を活性化させる.これらの因子のうち,機械的か代謝的か,いずれが重要なのかという疑問に答えようと試み,異なるタイプのトレーニングの際に,筋活動のホルモン応答を惹起し,筋組織における肥大性変化の機序を定義しようとした.
成長ホルモン濃度の増加が Ia 筋求心性神経活性に関連しているとのエビデンスがある (43). しかし,多くの著者は同化ホルモン濃度増加が作動筋での代謝変化に関与していると考えている (8,9,44,45). 実際,四肢の虚血はトレーニングおよび好気性運動時のホルモン応答を増強させる (10,20).
我々の試験 (46) では,弛緩なし低強度トレーニングにおける作動筋の血液供給の制限は同化ホルモン分泌を刺激すると仮定した.トレーニングプロトコルは上述した試験での L トレーニングと同様とした (39).
伝統的筋力トレーニング (85% 1RM) と弛緩なし低強度トレーニング (50% 1RM) とでは血中乳酸濃度の変化,および筋原性クレアチンキナーゼ活性に異なる結果をもたらすことが分かった.乳酸は解糖系の最終産物である.ゆえに,筋力トレーニングにおけるエネルギー供給は主に嫌気性経路により,血中乳酸レベルは作動筋における代謝過程の強度を間接的に示している.予想通り,作動筋への血液供給の遮断は血中乳酸濃度の著明な上昇を伴った.8 週間の筋力トレーニング期間の開始時(第 2 週中)のトレーニングセッション後に,伝統的な筋力トレーニング群(C 群)での血中乳酸濃度は 6.3 mmol/L であった.しかし,弛緩なし低強度トレーニング群(E 群)では 10.8 mmol/L に増加していた (Table 2). トレーニング期間の最後に両群間の差異は減少した.ゆえに,不完全な弛緩を伴うトレーニングセッション後の血中乳酸濃度は,仕事量が低いにもかかわらず,伝統的トレーニングセッション後より減少するのではなく大きくなった.
血中への筋原性クレアチンキナーゼ放出は作動筋の細胞膜の障害を間接的に反映しており,負荷量に依存することが分かっている.例えば,エキセントリック運動における CK 活性の上昇はコンセントリック運動よりも遥かに大きい (47,48,49). 我々の試験 (46) においては,トレーニング期間の第 2 週での MMCK 活性上昇は C 群(伝統的筋力トレーニング)では E 群(弛緩なし低強度トレーニング)より 73% 高かった (258 ± 69 IU/L vs. 149 ± 36 IU/L). これは C 群でのトレーニング負荷がより大きいことによるものである (85% 1RM vs. 50% 1RM). おそらく E 群の被検者において,作動筋での血流遮断が筋線維膜の障害を増強しなかったのだろう.これは次の知見とも一貫している.つまり,作動している四肢の閉塞は血中 CK 活性を上昇させないということである.214 mmHg の圧力で作動筋の血流を遮断した低強度 (20% 1RM) トレーニング翌日に閉塞なしで運動させた対照群と同等の CK レベルであった (20).
我々の試験 (46) で用いた二種のトレーニング負荷において乳酸と MMCK 濃度変化を比較することで,以下のことが示唆された.つまり,伝統的筋力トレーニングはより大きな筋線維への機械的障害をもたらし,血中への MMCK 放出の増加をもたらす.同時に,不完全な弛緩でのトレーニングセッション後に,強化された解糖は血中への乳酸の著明な蓄積をもたらす.ゆえに,伝統的筋力トレーニングは主に機械関連刺激を生成し,筋線維における同化プロセスを惹起する可能性がある.一方で不完全な弛緩でのトレーニング後には代謝性変化がより強く進展する.仮に不完全な弛緩での運動の主な機能が作動筋の血流遮断であると仮定するなら,筋肥大反応の機序を議論する上で,閉塞状態下でのトレーニングのデータを考慮しなくてはならない.例えば (21,22) では 4 週間の嫌気的運動(週に 4 回 1 回あたり 45 分間サイクリング 負荷~20% 1RM)を気密室内にて行い,下半身を 50 mmHg 加圧した結果トレーニングした脚の断面積が増加し,それは主に I 型および IIB 型の筋線維であった.著者らは筋肥大を次の二つだとみなしている.つまり,収縮タンパクの増加と,グリコーゲンおよび超水和物の増加とである.似たような結果がエリートラグビー選手で 8 週間のカフ圧 200 mmHg での虚血性低強度トレーニング(週 2 回, 1 回 4 セット, 50% 1RM)を行い,観察されている (50). Dynamic Force における増加および MRI での断面積増加はそれぞれ 14%, 15% であった.特異的な力および筋電図活動の増加を比較することで,著者らは筋体積の増加は主に収縮タンパクによるとの結論に至った.
GH およびインスリン様成長因子 (IGF-1) の分泌増加は,血流遮断に対抗するトレーニングによる筋肥大反応の周辺因子と考えられる.我々の試験 (46) では不完全な弛緩のトレーニングセッション後の血中 GH 濃度は高かった.筋線維への機械的効果が伝統的筋力トレーニングよりも小さかったにもかかわらず (Table 2). 弛緩なしのトレーニングが,トレーニングサイクル全体を通して高い GH 反応をもたらしたことは重要である.血中 GH の有意な増加が静脈閉塞を伴う嫌気性筋力トレーニングで認められた (10,20). 著者らによると,血流を制限されて作動している筋肉内の代謝産物が局所的に蓄積した反応における求心性神経 III および IV の活性化によるという (metaboreflex mechanism).
成長ホルモンの同化効果のメインシステムメディエーターは IGF-1 である.成長ホルモンに刺激された肝細胞により全身性に分泌され,収縮タンパク活動強度により骨格筋線維からオートクラインに分泌される (51). ゆえに,血中 IGF-1 の増加が高強度筋力トレーニング後に記録された (12,14). 我々の試験 (46) では,血中 IGF-1 レベルの増加は不完全な弛緩のトレーニングセッション後(第 2 週および第 7 週)にのみ記録された.伝統的筋力トレーニング(より大きな機械的負荷を特徴とする)後には IGF-1 濃度に変化は認められなかった (Table 2). 不完全な弛緩の筋力トレーニング後の IGF-1 増加は GH 分泌増加を背景として起きたことは特筆すべきことである (Table 2).
血流制限を伴う低強度運動は血中テストステロン値を増加させなかった (Table 2). それは他の著者らのデータとも一致している (52). 同時に,弛緩なしの低強度運動はコルチゾール分泌を増加させ,それは明らかに,この種のトレーニングの高い物理的コストを示唆している (Table 2).
ゆえに,弛緩なしの低強度 (50% 1RM) 運動は高レベルの血中 GH および IGF-1 分泌をもたらし,それは伝統的方法のより大きな外部負荷 (85% 1RM) よりも高い.おそらく,この現象は血流減少による不完全な弛緩でのトレーニングにおける筋肉内への代謝物のより高い蓄積によるものであり,必然的に,この種のトレーニングは筋肉の虚血状態下と同等になる.しかし,特筆すべきことだが,同化ホルモン分泌の事後刺激効果の代謝反射の機序はさらなる研究が必要である.筋力トレーニングに対するホルモン応答の研究において,結果は混乱している.West らは筋力増加および筋肥大に対する血中内因性ホルモンのレベル差を研究した (53). 著者らはこう結論している,つまり,筋力トレーニングにより起こる成長ホルモンと IGF-1 レベルの増加は筋肥大プロセスの主要な刺激ではないと.筋タンパク合成の調節は,彼らによれば,主に細胞内の機械的・代謝的刺激によるという.
Effects of high-intensity strength training and low-intensity strength training without relaxation of muscles on the expression of genes regulating myogenesis.
過去十年間で分子生物学的手法は,多様な身体活動に筋肉が適応する機序を解明し,異なるトレーニングプログラムの効率を定義するのに広く用いられてきた.筋細胞で発現している遺伝子を解析することで,個々の被験者に独立に,一つのトレーニングセッションの結果に基づいて,異なるトレーニングプロトコルの効率を評価することが可能となった.1 セッションの高強度筋力トレーニングが,回復日とより長い期間に筋形成調節遺伝子の発現を変化させることが明らかになった.例えば IGF-1, MGF, MyoD, Myogenin, そしてミオスタチン (54,55). 血流制限を伴う低強度トレーニング (20% 1RM) が研究された遺伝子発現の変化に至ることも分かった.同じ強度でトレーニングした対照群においては,発現の変化は見られなかったのであるが (56,57). これは次の事実による.つまり,伝統的筋力トレーニングでは,より大きな外部負荷 (70-90% 1RM) が主として用いられている.一方,引用した試験では,対照群として 20% 1RM の負荷が用いられており,その程度の負荷では身体活動の活発な人には筋形成調節遺伝子発現を変化させるには小さすぎるのかも知れない.上述したように,血流を遮断した運動で作動筋に著明な代謝ストレスを達成するには負荷は少なくとも 30-40% 1RM であるべきだ (25). ゆえに,我々は筋弛緩なしの筋力トレーニング (50% 1RM) 後の筋形成調節遺伝子発現の変化と,伝統的筋力トレーニング後の変化とを比較することにした.
運動時の異なる筋群間の負荷の再分配効果を排除するため,また細胞内シグナリングの同化ホルモン分泌増加のインパクトを排除するために,ニーエクステンションが選ばれた.小さな筋体積の関与する筋力トレーニングでは同化ホルモン分泌増加につながらない (53,58) ことが知られている.今回の試験では,低強度トレーニング (50% 1RM) において,毛細血管内の乳酸濃度がわずかに上昇した (3.1 ± 0.5 mmol/L). 高強度トレーニングセッション後には 6.3 ± 0.6 mmol/L にまで上昇した.弛緩なしの低強度トレーニング後には乳酸濃度は最高値に達した (7.4 ± 0.5 mmol/L). 予想されたように,同化ホルモンの含有量であるテストステロンと IGF-1 は 8 週間のトレーニング後でさえ変化しなかった.GH の含有量は高強度トレーニング後にわずかに増加した.
今日の総説によると,成人においては,IGF-1 蛋白は骨格筋から分泌され,筋肥大を起こしうる.これは主にサテライト細胞の分化と既存の筋線維への融合によるものである (59,60). さらに,IGF-1 による筋蛋白異化の抑制効果として Akt-FOXO シグナル経路 (61) があり,Akt-mTORC1 の活性化によるタンパク合成率の増加が議論されている (60,62). 我々の試験では,回復期におけるインスリン様成長因子 (IGF-1Ea) 筋アイソフォームの発現は変化していなかった (Fig. 2).
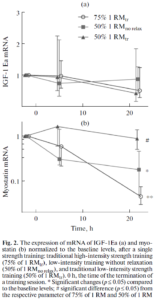
筋肉の成長の抑制的な調節因子であるミオスタチン遺伝子の発現への影響をトレーニングレジメン間で比較した.弛緩なしの運動後 5 時間でミオスタチン mRNA 濃度は 4 分の 1 に低下し,さらに運動後 22 時間までそのレベルが持続した (Fig. 2). 高強度トレーニングの後では,ミオスタチン mRNA 濃度は回復期の 22 時間後まで持続的に低下した(トータルで 20 分の 1 まで).特筆すべきことだが,低強度の伝統的トレーニング後では,この遺伝子発現には変化がなかった.ミオスタチン遺伝子発現の低下は Akt-mTORC1 経路のシグナルキナーゼ活性の増加に関連している (63) 一方で,ミオスタチン発現低下は FOXO 転写因子の活性を低下させる可能性があり, mRNA リガーゼ E3 の発現を刺激してサテライト細胞の分化を阻害する (64,65).
ゆえに,モードの異なる筋力トレーニングは筋形成調節遺伝子の発現が異なる結果となる.高強度トレーニングは弛緩なしの低強度トレーニングよりもミオスタチン発現が大きく低下する.明らかに,筋力トレーニングの異なる型の効果を詳細に特徴づけるために,筋原線維タンパク合成率の変化と,タンパク合成率を調節するシグナル経路の活性化を評価しなくてはならない.これらの課題は将来の研究が解決すべきである.
CONCLUSIONS
筋力トレーニングの異なる型の効率を比較することで次のことが示された.すなわち,作動筋の弛緩なしの低強度筋力トレーニング (50% 1RM) 後においては,筋力の能力の増加と作動筋のサイズの増加とは伝統的な高強度筋力トレーニング (80-85% 1RM) ほどには大きくない.筋肥大は伝統的な筋力トレーニングでも弛緩なしのトレーニングでも引き起こされるが,明らかに異なる経路で達成される.伝統的な筋力トレーニングでは,機械的刺激は筋線維に同化プロセスを惹起し,主に生成される.弛緩なしのトレーニングでは,筋肉における嫌気反応の活性化が明白になればなるほど,代謝反応の結果として血中 GH, IGF-1 およびコルチゾールの分泌増加が明白になる.高強度トレーニングと筋弛緩なしの低強度トレーニングは,筋形成調節遺伝子ミオスタチン発現の動態の違いにより特徴づけられる.トリガー機構の違いは,二種類のトレーニングの影響下での肥大性変化の特徴の違いと組み合わせられる.古典的な筋力トレーニングでは,断面積に占める II 型筋線維の優先的な増加を認める.弛緩なしのトレーニングでは,断面積では I 型筋線維の優先的な増加を認める.
本試験はスポーツ,特に筋力と歩行筋の持久力が高度に要求されるスポーツの実践において有用である可能性がある.さらに,相対的に低負荷のトレーニングは靭帯を損傷から保護する.この特徴はこのトレーニングレジメンがフィットネス及びリハビリテーション医学に有用となることを可能にし,筋力トレーニングは外傷後の筋の運動耐容能をサポートする方法と同じくらい安全である.
REFERENCES
1. Hurley, B.F., Hanson, E.D., and Sheaff, A.K., Strength training as a countermeasure to aging muscle and chronic disease, Sports Med., 2011, vol. 41, no. 4, p. 289.
2. Evans, W.J., Meredith, C.N., Cannon, J.G., et al., Metabolic changes following eccentric exercise in trained and untrained men, J. Appl. Physiol., 1986, vol. 61, no. 5, p. 1864.
3. McCarthy, J.J. and Esser, K.A., Anabolic and catabolic pathways regulating skeletal muscle mass, Curr. Opin. Clin. Nutr. MeTable Care, 2010, vol. 13, no. 3, p. 230.
4. Suga, T., Okita, K., Takada, S., et al., Effect of multiple set on intramuscular metabolic stress during low intensity resistance exercise with blood flow restriction, Eur. J. Appl. Physiol., 2012, vol. 112, p. 3915.
5. Takada, S., Okita, K., Suga, T., et al., Low intensity exercise can increase muscle mass and strength proportionally to enhanced metabolic stress under ischemic conditions, J. Appl. Physiol., 2012, vol. 113, no. 2, p. 199.
6. Ingwall, J.S., Weiner, C.D., Morales, M.F., et al., Specificity of creatine in the control of muscle protein synthe sis, J. Cell Biol., 1974, vol. 62, no. 1, p. 145.
7. Wallimann, T., Tokarska-Schlattner, M., and Schlattner, U., The creatine kinase system and pleiotropic effects of creatine, Amino Acids, 2011, vol. 40, no. 5, p. 1271.
8. Lin, H.S., Wang, W., Wang, R.Y., et al., Stimulatory effect of lactate on testosterone production by rat leydig cells, J. Cell Biochem., 2001, vol. 83, p. 147.
9. Lu, S.S., Lau, C.P., Tung, Y.F., et al., Lactate and the effects of exercise on testosterone secretion: evidence for the involvement of a camp-mediated mechanism, Med. Sci. Sports Exerc., 1997, vol. 29, no. 8, p. 1048.
10. Viru, M., Jansson, E., Viru, A., et al., Effect of restricted blood flow on exercise-induced hormone changes in healthy men, Eur. J. Appl. Physiol. Occup. Physiol., 1998, vol. 77, no. 6, p. 517.
11. Ahtiainen, J.P., Pakarinen, A., Alen, M., et al., Muscle hypertrophy, hormonal adaptations and strength development during strength training in strength-trained and untrained men, Eur. J. Appl. Physiol., 2003, vol. 89, no. 6, p. 555.
12. Kraemer, W.J., Marchitelli, L., Gordon, S.E., et al., Hormonal and growth factor responses to heavy resistance exercise protocols, J. Appl. Physiol., 1990, vol. 69, no. 4, p. 1442.
13. Kraemer, W.J., Staron, R.S., Hagerman, F.C., et al., The effects of shortterm resistance training on endocrine function in men and women, Eur. J. Appl. Physiol. Occup. Physiol., 1998, vol. 78, no. 1, p. 69.
14. Rojas, V.S., Knicker, A., Hollmann, W., et al., Effect of resistance exercise on serum levels of growth factors in humans, Horm. MeTable Res., 2010, vol. 42, no. 13, p. 982.
15. Fry, C.S., Glynn, E.L., Drummond, M.J., et al., Blood flow restriction exercise stimulates mTORC1 signaling and muscle protein synthesis in older men, J. Appl. Physiol., 2010, vol. 108, no. 5, p. 1199.
16. Fujita, S., Abe, T., Drummond, M.J., et al., Blood flow restriction during low-intensity resistance exercise increases S6K1 phosphorylation and muscle protein synthesis, J. Appl. Physiol., 2007, vol. 103, no. 3, p. 903.
17. Laurentino, G.C., Ugrinowitsch, C., Roschel, H., et al., Strength training with blood flow restriction diminishes myostatin gene expression, Med. Sci. Sports Exerc., 2012, vol. 44, no. 3, p. 406.
18. Burgomaster, K.A., Moore, D.R., Schofield, L.M., et al., Resistance training with vascular occlusion: metabolic adaptations in human muscle, Med. Sci. Sports Exerc., 2003, vol. 35, no. 7, p. 1203.
19. Moore, D.R., Burgomaster, K.A., Schofield, L.M., et al., Neuromuscular adaptations in human muscle following low intensity resistance training with vascular occlusion, Eur. J. Appl. Physiol., 2004, vol. 92, nos. 4–5, p. 399.
20. Takarada, Y., Nakamura, Y., Aruga, S., et al., Rapid increase in plasma growth hormone after low-intensity resistance exercise with vascular occlusion, J. Appl. Physiol., 2000, vol. 88, no. 1, p. 61.
21. Nygren, A.T., Sundberg, C.J., Goransson, H., et al., Effects of dynamic ischaemic training on human skeletal muscle dimensions, Eur. J. Appl. Physiol., 2000, vol. 82, nos. 1–2, p. 137.
22. Sundberg, C.J., Exercise and training during graded leg ischaemia in healthy man with special reference to effects on skeletal muscle, Acta Physiol. Scand., vol. 615, no. Suppl. 1994, p. 1.
23. Duchateau, J. and Hainaut, K., Isometric or dynamic training: differential effects on mechanical properties of a human muscle, J. Appl. Physiol., 1984, vol. 56, no. 2, p. 296.
24. Seluyanov, V.N., Podgotovka beguna na srednie distantsii (Middle Distance Runner Training), Moscow: SporAkademPress, 2001.
25. Suga, T., Okita, K., Morita, N., et al., Dose effect on intramuscular metabolic stress during low-intensity resistance exercise with blood flow restriction, J. Appl. Physiol., 2010, vol. 108, no. 6, p. 1563.
26. Nielsen, J.L., Aagaard, P., Bech, R.D., et al., Proliferation of myogenic stem cells in human skeletal muscle in response to low-load resistance training with blood flow restriction, J. Physiol., 2012, vol. 590.
27. Takada, S., Okita, K., Suga, T., et al., Blood flow restriction exercise in sprinters and endurance runners, Med. Sci. Sports Exerc., 2012, vol. 44, no. 3, p. 413.
28. Hayot, M., Michaud, A., Koechlin, C., et al., Skeletal muscle microbiopsy: a validation study of a minimally invasive technique, Eur. Respir. J., 2005, vol. 25, no. 3, p. 431.
29. Bergstrom, J. and Hultman, E., A study of the glycogen metabolism during exercise in man, Scand. J. Clin. Lab. Invest., 1967, vol. 19, no. 3, p. 218.
30. Pfaffl, M.W., A new mathematical model for relative quantification in real-time RT-PCR, Nucleic Acid Res., 2001, vol. 29, no. 9, p. e45.
31. Voronov, A.V., Anatomy and biomechanical properties of lower limb muscles and joints, in Fizkul’tura, obrazovanie i nauka (Physical Training, Education, and Science), Moscow, 2003.
32. Henneman, E., Somjen, G., and Carpenter, D.O., Functional significance of cell size in spinal motoneurons, J. Neurophysiol., 1965, vol. 28, p. 560.
33. Shenkman, B.S., Litvinova, K.S., Gasnikova, N.M., et al., Creatine as a metabolic controller of skeletal muscles structure and function in strength exercises in humans. The cellular mechanisms, Ross. Fiziol. Zh. im. I.M. Sechenova, 2006, vol. 92, no. 1, p. 100.
34. Hather, B.M., Tesch, P.A., Buchanan, P., et al., Influence of eccentric actions on skeletal muscle adaptations to resistance training, Acta Physiol. Scand., 1991, vol. 143, no. 2, p. 177.
35. Houston, M.E., Froese, E.A., Valeriote, S.P., et al., Muscle performance, morphology and metabolic capacity during strength training and detraining: a one leg model, Eur. J. Appl. Physiol. Occup. Physiol., 1983, vol. 51, no. 1, p. 25.
36. Staron, R.S., Malicky, E.S., Leonardi, M.J., et al., Muscle hypertrophy and fast fiber type conversions in heavy resistance-trained women, Eur. J. Appl. Physiol. Occup. Physiol., 1990, vol. 60, no. 1, p. 71.
37. Koopman, R., Zorenc, A.H., Gransier, R.J., et al., Increase in S6K1 phosphorylation in human skeletal muscle following resistance exercise occurs mainly in type ii muscle fibers, Am. J. Physiol. Endocrinol. Metab., 2006, vol. 290, no. 6, p. E1245.
38. Tannerstedt, J., Apro, W., and Blomstrand, E., Maximal lengthening contractions induce different signaling responses in the type i and type ii fibers of human skeletal muscle, J. Appl. Physiol., 2009, vol. 106, no. 4, p. 1412.
39. Netreba, A.I., Popov, D.V., Lyubaeva, E.V., et al., Physiological effects of using the low intensity strength training without relaxation in single-joint and multi-joint movements, Ross. Fiziol. Zh. im. I.M. Sechenova, 2007, vol. 93, no. 1, p. 27.
40. Tesch, P., Sjodin, B., and Karlsson, J., Relationship between lactate accumulation, LDH activity, LDH isozyme and fibre type distribution in human skeletal muscle, Acta Physiol. Scand., 1978, vol. 103, no. 1, p. 40.
41. Humphreys, P.W. and Lind, A.R., The blood flow through active and inactive muscles of the forearm during sustained handgrip contractions, J. Physiol., 1963, vol. 166, p. 120.
42. Tesch, P. and Karlsson, J., Lactate in fast and slow twitch skeletal muscle fibres of man during isometric contraction, Acta Physiol. Scand., 1977, vol. 99, no. 2, p. 230.
43. McCall, G.E., Grindeland, R.E., Roy, R.R., et al., Muscle afferent activity modulates bioassayable growth hormone in human plasma, J. Appl. Physiol., 2000, vol. 89, no. 3, p. 1137.
44. Gordon, S.E., Kraemer, W.J., Vos, N.H., et al., Effect of acid-base balance on the growth hormone response to acute high-intensity cycle exercise, J. Appl. Physiol., 1994, vol. 76, no. 2, p. 821.
45. Kraemer, W.J., Patton, J.F., Gordon, S.E., et al., Compatibility of high-intensity strength and endurance training on hormonal and skeletal muscle adaptations, J. Appl. Physiol., 1985, vol. 78, no. 3, p. 976.
46. Popov, D.V., Tsvirkun, D.V., Netreba, A.I., et al., Hormonal adaptation determines the increase in muscle mass and strength during low-intensity strength training without relaxation, Human Physiol., 2006, vol. 32, no. 5, p. 609.
47. Cerney, F. and Haralambie, G., Exercise-induce loss of muscles enzymes, in Biochemistry of Exercise, Knuttgen, H.G., Ed., Human Kinetics, 1993, p. 441.
48. Newham, D.J., McPhail, G., Mills, K.R., et al., Ultra structural changes after concentric and eccentric con tractions of human muscle, J. Neurol. Sci., 1983, vol. 61, no. 1, p. 109.
49. Newham, D.J., Jones, D.A., and Edwards, R.H., Plasma creatine kinase changes after eccentric and concentric contractions, Muscle Nerve, 1986, vol. 9, no. 1, p. 59.
50. Takarada, Y., Sato, Y., and Ishii, N., Effects of resistance exercise combined with vascular occlusion on muscle function in athletes, Eur. J. Appl. Physiol., 2002, vol. 86, no. 4, p. 308.
51. Goldspink, G., Mechanical signals, IGFI gene splicing, and muscle adaptation, Physiology (Bethesda), 2005, vol. 20, p. 232.
52. Reeves, G.V., Kraemer, R.R., Hollander, D.B., et al., Comparison of hormone responses following light resistance exercise with partial vascular occlusion and moderately difficult resistance exercise without occlusion, J. Appl. Physiol., 2006, vol. 101, no. 6, p. 1616.
53. West, D.W., Burd, N.A., Tang, J.E., et al., Elevations in ostensibly anabolic hormones with resistance exercise enhance neither training-induced muscle hypertrophy nor strength of the elbow flexors, J. Appl. Physiol., 2010, vol. 108, no. 1, p. 60.
54. McKay, B.R., O’Reilly, C.E., Phillips, S.M., et al., Coexpression of IGF-1 family members with myogenic regulatory factors following acute damaging muscle-lengthening contractions in humans, J. Physiol., 2008, vol. 586.
55. Yang, Y., Creer, A., Jemiolo, B., et al., Time course of myogenic and metabolic gene expression in response to acute exercise in human skeletal muscle, J. Appl. Physiol., 2005, vol. 98, no. 5, p. 1745.
56. Drummond, M.J., Fujita, S., Abe, T., et al., Human muscle gene expression following resistance exercise and blood flow restriction, Med. Sci. Sports Exerc., 2008, vol. 40, no. 4, p. 691.
57. Manini, T.M., Vincent, K.R., Leeuwenburgh, C.L., et al., Myogenic and proteolytic mRNA expression following blood flow restricted exercise, Acta Physiol. (Oxford), 2011, vol. 201, no. 2, p. 255.
58. Hansen, S., Kvorning, T., Kjaer, M., et al., The effect of short-term strength training on human skeletal muscle: the importance of physiologically elevated hormone levels, Scand. J. Med. Sci. Sports, 2001, vol. 11, no. 6, p. 347.
59. Jacquemin, V., Furling, D., Bigot, A., et al., IGF-1 induces human myotube hypertrophy by increasing cell recruitment, Exp. Cell Res., 2004, vol. 299, no. 1, p. 148.
60. Jacquemin, V., ButlerBrowne, G.S., Furling, D., et al., IL-13 mediates the recruitment of reserve cells for fusion during IGF-1-induced hypertrophy of human myotubes, J. Cell Sci., 2007, vol. 120, p. 670.
61. Sandri, M., Sandri, C., Gilbert, A., et al., Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin1 and cause skeletal muscle atrophy, Cell, 2004, vol. 117, no. 3, p. 399.
62. Rommel, C., Bodine, S.C., Clarke, B.A., et al., Mediation of IGF-1-induced skeletal myotube hypertrophy by PI(3)K/Akt/mTOR AND PI(3)K/Akt/GSK3 path ways, Nat. Cell Biol., 2001, vol. 3, no. 11, p. 1009.
63. Amirouche, A., Durieux, A.C., Banzet, S., et al., Down regulation of Akt/mammalian target of rapamycin sig naling pathway in response to myostatin overexpression in skeletal muscle, Endocrinology, 2009, vol. 150, no. 1, p. 286.
64. McFarlane, C., Plummer, E., Thomas, M., et al., Myostatin induces cachexia by activating the ubiquitin proteolytic system through an NF-kappab-independent, foxo1-dependent mechanism, J. Cell Physiol, 2006, vol. 209, no. 2, p. 501.
65. Van Wessel, T., van der Laarse, W.J., et al., The muscle fiber type-fiber size paradox: hypertrophy or oxidative metabolism?, Eur. J. Appl. Physiol., 2010, vol. 110, no. 4, p. 665.

“トレーニングの最適化:安全な筋力トレーニングにおける新しい進展” への1件の返信